 资源简介
资源简介
2025年兰州市高三诊断考试
化学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号框涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号框。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 K-39 Cu-64 I-127 Pb-207
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1. 文物承载着人类的文明与智慧。下列有关文物的叙述不正确的是
A. 武威出土的铜奔马属于合金材料
B. 马家窑出土的陶器属于硅酸盐产品
C. 甘肃简牍博物馆珍藏的竹简主要成分属于多糖
D. 敦煌壁画绘制用到的红色颜料为
2. 化学用语是描述化学物质组成及变化的专业语言符号。下列有关表述不正确的是
A. 用电子云轮廓图示意键的形成:
B. 的价层电子轨道表示式为:
C. 价层电子对互斥(VSEPR)模型:
D. 的形成过程:
3. 科技工作者研究、利用化学知识造福人类,彰显了劳动者的智慧与精神。下列有关说法不正确的是
A. 酿酒师酿造葡萄酒添加目是起杀菌和抗氧化等作用
B. 医生做“钡餐”透视时病人吞服的钡餐主要成分是
C. 材料科学家研制的包装材料聚乳酸()是由加聚而成
D. 环境保护工程师利用除去废水中的
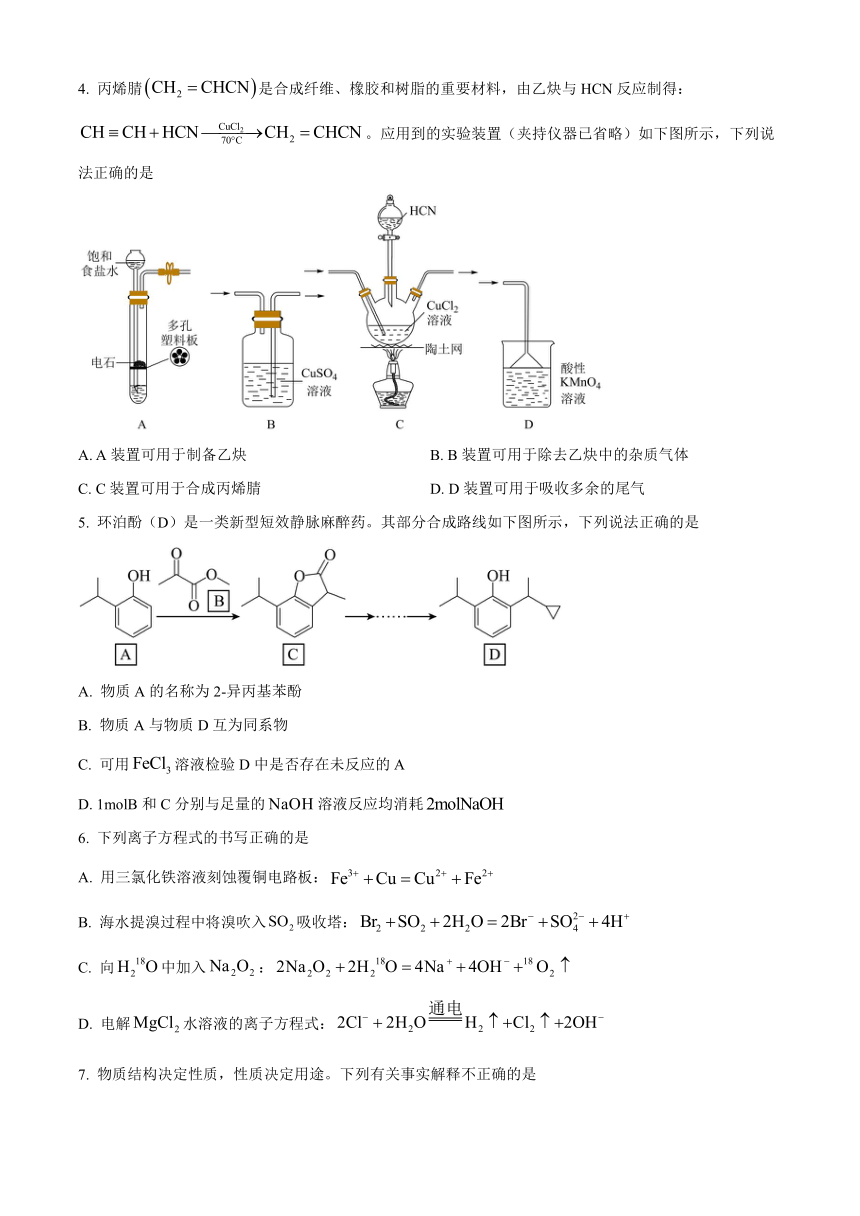
4. 丙烯腈是合成纤维、橡胶和树脂的重要材料,由乙炔与HCN反应制得:。应用到的实验装置(夹持仪器已省略)如下图所示,下列说法正确的是
A. A装置可用于制备乙炔 B. B装置可用于除去乙炔中的杂质气体
C. C装置可用于合成丙烯腈 D. D装置可用于吸收多余的尾气
5. 环泊酚(D)是一类新型短效静脉麻醉药。其部分合成路线如下图所示,下列说法正确的是
A. 物质A的名称为2-异丙基苯酚
B. 物质A与物质D互为同系物
C. 可用溶液检验D中是否存在未反应的A
D. 1molB和C分别与足量的溶液反应均消耗
6. 下列离子方程式的书写正确的是
A. 用三氯化铁溶液刻蚀覆铜电路板:
B. 海水提溴过程中将溴吹入吸收塔:
C. 向中加入:
D. 电解水溶液的离子方程式:
7. 物质结构决定性质,性质决定用途。下列有关事实解释不正确的是
选项 事实 解释
A 将无水乙醇加入溶液中析出深蓝色晶体 乙醇分子极性较小,降低了的溶解性
B 石墨能导电 未杂化的p轨道重叠使电子在整个碳原子平面内运动
C 的酸性强于 F的电负性大于
D 的熔点低于 引入乙基改变了晶体的类型
A. A B. B C. C D. D
8. 离子化合物水解可用于制备石墨,其反应原理为(石墨,s,表示阿伏加德罗常数的值。下列说法正确的是
A. 2.7g中含有的离子总数为
B. 常温下,的溶液中含的数目为
C. 7.2g单层石墨中含有六元环的数目为
D. 每生成3.36L,转移电子的数目为
9. 钙钛矿太阳能电池材料中含有前四周期X、Y、Z、W四种元素。基态X原子s能级上的电子数是p能级上电子数的2倍,Y的第一电离能在同周期中仅小于两种元素,Z元素形成的单质为淡黄色固体,X、Z的质子数之和等于W的质子数。下列说法中正确的是
A. 基态原子中未成对电子数:
B. 简单氢化物的沸点:
C. 只有Z的最高价氧化物对应水化物为强酸
D. W位于第四周期、第ⅡB族
10. 下列设计的实验方案不能达到实验目的的是
选项 实验目的 实验方案
A 探究温度对化学平衡的影响 取两支试管,分别加入2mL0.5溶液,将其中的一支试管先加热,然后置于冷水中,分别与另一支试管进行对比,观察溶液颜色变化
B 验证溴乙烷发生消去反应 向溴乙烷中加入的乙醇溶液,加热,将产生的气体通入酸性溶液中,观察溶液是否褪色
C 比较和的大小 常温下,向0.1溶液中先滴加少量0.1溶液,振荡后再滴加少量0.1溶液,观察沉淀颜色变化
D 鉴别蔗糖和麦芽糖溶液 分别向两种无色溶液中滴加新制氢氧化铜悬浊液,加热、观察是否有砖红色沉淀生成
A. A B. B C. C D. D
11. 某研究所设计以软锰矿(主要成分为,含少量、等的氧化物)为原料制备,其实验流程如下:
已知:固体和溶液均为墨绿色。
下列说法正确的是
A. “熔融煅烧”过程中使用到的仪器主要有蒸发皿,三脚架和酒精灯
B. “滤渣1”的成分是
C. “调pH2”过程中反应的离子方程式为
D. “结晶”过程中获得晶体可采用降温结晶法
12. 科学家为消除酸性工业废水中甲醛的危害,利用驱动耦合电催化实现了与转化为高附加值的产品。下图是耦合电催化反应系统原理图示。下列有关说法不正确的是
A. 管负载纳米绒电极为阴极
B. 反应过程中从左极室向右极室移动
C. 电路中通过2mol电子时,在装置中可生成1mol
D. 阳极的电极反应式为
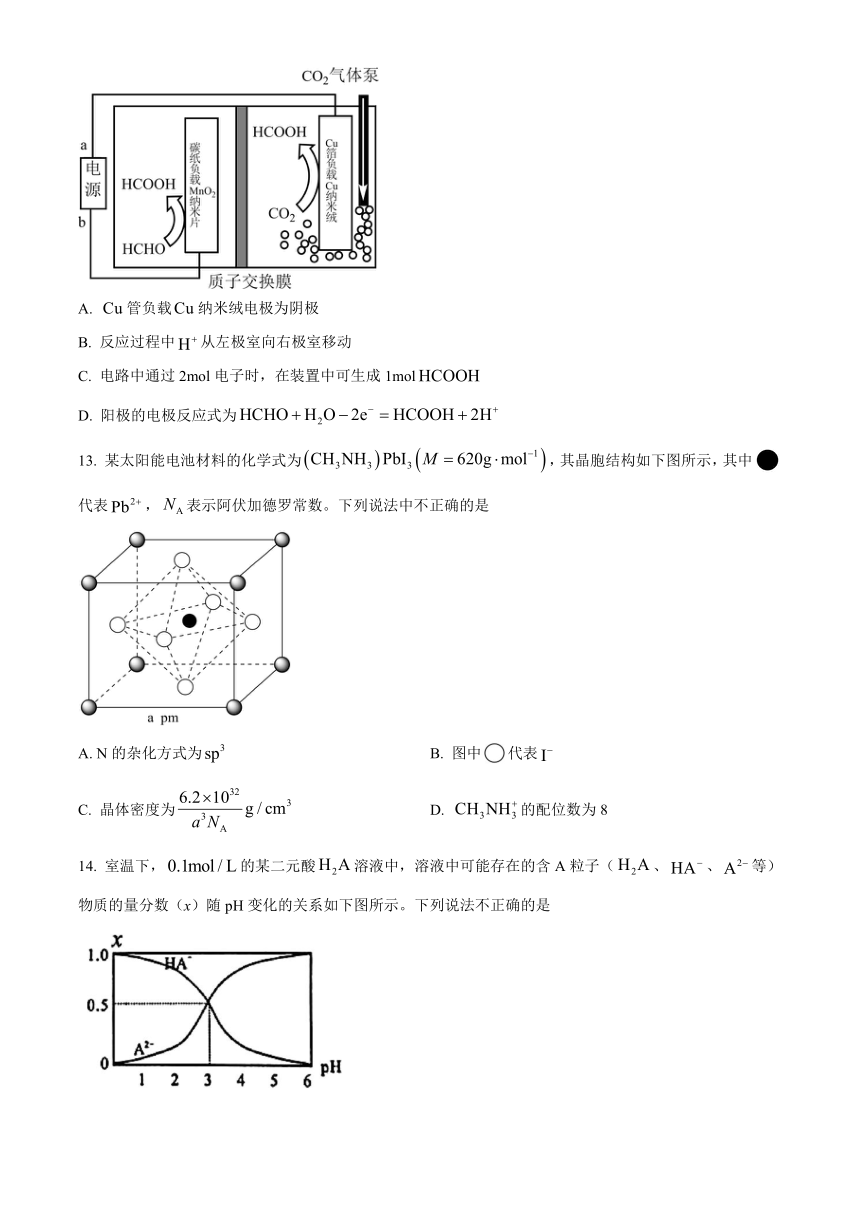
13. 某太阳能电池材料的化学式为,其晶胞结构如下图所示,其中代表,表示阿伏加德罗常数。下列说法中不正确的是
A. N的杂化方式为 B. 图中代表
C. 晶体密度为 D. 的配位数为8
14. 室温下,的某二元酸溶液中,溶液中可能存在的含A粒子(、、等)物质的量分数(x)随pH变化的关系如下图所示。下列说法不正确的是
A. 电离方程式为,
B. 室温下,
C. 将相同物质的量的和固体溶于水所得混合溶液,离子浓度大小关系为
D. 时,溶液中存在
二、非选择题:本题共4小题,共58分。
15. 海洋锰结核是一种富含多种金属元素矿物资源,从中提取的金属在钢铁、电子、航天领域有着广泛的用途。其主要成分为锰、镍、铜、钴、铁等金属的氧化物。从锰结核中回收金属的工艺流程如下:
已知:①“还原熔炼”后得到富锰渣和粗合金。
②“加压酸浸”后、、元素均以二价盐的形式存在。
③常温下,相关金属离子()生成氢氧化物沉淀的pH如下表:
金属离子
开始沉淀的pH 1.3 6.5 4.2 7 6.8
完全沉淀()的pH 3 9 6.7 9.2 9.2
(1)“加压酸浸”过程中加压的目的是________。
(2)滤渣主要成分是________,“调pH”操作中pH的控制范围为________,该过程中发生反应的离子方程式为________。
(3)“电解沉积镍”的过程中使用石墨电极,阳极的电极反应式为________。
(4)萃取剂Ⅰ为,“萃取铜”后铜元素的存在形式为,其中铜元素的配位数为________。萃取后通过________操作将其分离出来。请解释萃取剂Ⅰ能萃取分离铜元素的原因________。
16. 二草酸合铜(Ⅱ)酸钾是一种重要的配合物,具有特殊的结构和性质,制备流程如下:
已知:1.
2.二草酸合铜(Ⅱ)酸钾微溶于冷水,可溶于热水,难溶于乙醇。
实验步骤:
步骤1:制备:称取2.5g硫酸铜晶体(),溶于水,滴入过量的溶液,加热煮沸,冷却,用下图所示的装置抽滤,然后用蒸馏水洗涤,得到氧化铜。
步骤2:制取:将晶体加入蒸馏水中,微热,溶解过程中温度不能超过85℃,待充分溶解后分次加入,反应生成。
步骤3:制备二草酸合铜(Ⅱ)酸钾:将与混合液在50℃加热至反应充分,得到二草酸合铜(Ⅱ)酸钾。反应结束后将溶液冷却至室温,再置于冰水浴中冷却,析出晶体,过滤并用乙醇洗涤晶体。
请回答:
(1)步骤1称取2.5g硫酸铜晶体,需要用到的仪器有________。抽滤时将仪器接在水龙头上,其作用是________。用蒸馏水洗涤氧化铜时,证明已洗涤干净的方法:________。
(2)步骤2溶解过程中温度不能超过85℃的原因是________。
(3)步骤3制备二草酸合铜(Ⅱ)酸钾反应的化学方程式为________。加热温度控制在50℃可以采取的加热措施是________,用乙醇洗涤晶体的目的是________。
(4)将制得的进行热重分析,结果如下图所示,由图可知在C点剩余固体为和________。
17. 煤制甲醇工业对国家能源安全和化工产业发展意义重大。其主要流程分为煤气化和合成甲醇:
Ⅰ.煤气化的主要反应:
反应1:
反应2:
请回答:
(1)反应的________,在________(选填“低温”、“高温”或“任意温度”)条件下有利于该反应自发进行。
(2)在恒温恒容容器内进行反应1和反应2,下列说法正确的有________(填序号)。
A. 混合气体的密度保持不变时,说明反应体系已达到平衡
B. 平衡时的体积分数可能大于
C. 平衡时向容器中充入惰性气体,平衡体系中的体积分数不变
D. 平衡时缩小容器体积,平衡体系中减小
(3)研究人员结合实验与计算机模拟结果揭示了在金催化剂表面上反应2的反应历程(如下图所示),其中吸附在金催化剂表面上的物质用*标注。该历程中决定反应2速率的步骤方程式为________。
(4)在一定温度下,向体积固定的密闭容器中加入足量的和同时发生反应1和反应2,起始压强为0.1MPa,平衡时的转化率为50%,的物质的量是为0.1mol,则反应1的平衡常数________。(已知为分压平衡常数,分压=总压物质的是分数)
Ⅱ.合成甲醇的主要反应为 。
(5)在其他条件一定时,甲醇的产量随温度和压强的变化趋势如上图所示,其中压强最大的是________(选填)。
(6)在550K、条件下,M点所示的反应状态中甲醇的生成速率________甲醇的消耗速率(选填“>”“<”或“=”)。
(7)请解释甲醇的产量随温度变化的原因________。
18. 阿法替尼(Afatinib)是不可逆型酪氨酸激酶抑制剂,可持久地抑制肿瘤细胞的增殖和生长,其工业合成路线如下图所示:
请回答:
(1)B中含氧官能团的名称为________。
(2)F、H的结构简式分别为________、________。
(3)反应D→E的反应类型为________。
(4)反应I→J的化学方程式为________。
(5)C有多种同分异构体,符合下列条件的同分异构体有________种(不考虑立体异构)。
a.能发生银镜反应 b.不含醚键
其中核磁共振氢谱有3组峰;峰面积之比为6:1:1的结构简式为________(任写一个即可)。
2025年兰州市高三诊断考试
化学 参考答案
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
【1题答案】
【答案】D
【2题答案】
【答案】B
【3题答案】
【答案】C
【4题答案】
【答案】D
【5题答案】
【答案】A
【6题答案】
【答案】B
【7题答案】
【答案】D
【8题答案】
【答案】C
【9题答案】
【答案】A
【10题答案】
【答案】B
【11题答案】
【答案】D
【12题答案】
【答案】C
【13题答案】
【答案】D
【14题答案】
【答案】C
二、非选择题:本题共4小题,共58分。
【15题答案】
【答案】(1)提高反应速率,增大浸取率
(2) ①. ②. 3~4.2 ③.
(3)
(4) ①. 4 ②. 分液 ③. 萃取剂Ⅰ难溶于水,且能与形成配位键
【16题答案】
【答案】(1) ①. 托盘天平、药匙 ②. 抽气,减小吸滤瓶、安全瓶中的压强,加快过滤速度 ③. 取最后一次洗涤滤液于洁净的试管中,加入盐酸酸化的氯化钡溶液,若无白色沉淀生成,则说明已洗涤干净(其他合理答案也可)
(2)防止草酸分解 (3) ①. ②. 水浴加热 ③. 洗去晶体表面杂质和水分,减少洗涤中晶体溶解造成的产物损失,加速晶体干燥
(4)
【17题答案】
【答案】(1) ①. ②. 高温 (2)AC
(3)(或)
(4)0.01MPa (5)
(6)< (7)时,反应未达平衡,其他条件不变时,随着温度的升高,化学反应速率加快,甲醇的产量增大:时,反应已达平衡,随着温度的升高,反应平衡逆移,甲醇产量降低
【18题答案】
【答案】(1)硝基、(酚)羟基
(2) ①. ②.
(3)还原反应 (4)
(5) ①. 7 ②. 和
展开更多......
收起↑
 资源预览
资源预览



 资源预览
资源预览




