 资源简介
资源简介
(共21张PPT)
第3课时
硝酸 酸雨及防治
课时
安排
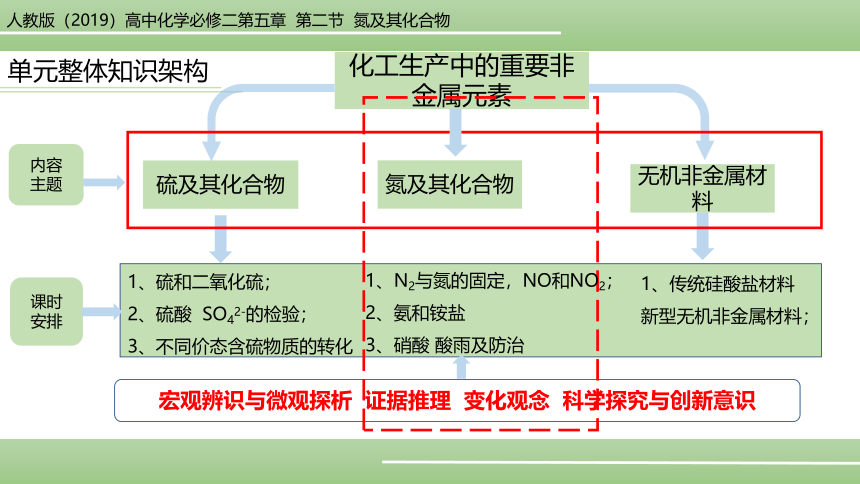
化工生产中的重要非金属元素
单元整体知识架构
硫及其化合物
无机非金属材料
内容
主题
1、硫和二氧化硫;
2、硫酸 SO42-的检验;
3、不同价态含硫物质的转化
1、传统硅酸盐材料 新型无机非金属材料;
宏观辨识与微观探析 证据推理 变化观念 科学探究与创新意识
氮及其化合物
1、N2与氮的固定,NO和NO2;
2、氨和铵盐
3、硝酸 酸雨及防治
学习目标
1.结合真实情境并通过实验探究,了解硝酸的主要性质。
3.结合真实情境,认识硫、氮化合物对生态环境的影响,了解酸雨及防治。
第二节 氮及其化合物
硝酸 酸雨及防治
2.认识硝酸在工业和农业生产中的重要意义。
活动一:创设问题情景,导入新课
【问题1】同学们还记得六大强酸都包括哪些吗?从店里的角度出发,大家还记得强酸有哪些共同的特点呢?
六大强酸:盐酸、硫酸、硝酸、氢溴酸、氢碘酸、高氯酸
强酸在水溶液中均能完全电离
【过度】今天我们就来继续学习与N元素相关的化合物,硝酸的相关知识。
活动二:通过实验探究 学习硝酸的性质
1、硝酸的物理性质
硝酸是无色、易挥发、有刺激性气味的液体。浓硝酸见光或者受热易分解产生二氧化氮,所以一般保存在棕色试剂瓶中,并放在阴凉处。
刚倒出来
久置后
活动二:通过实验探究 学习硝酸的性质
价类二维图——从物质分类和化合价的角度预测硝酸的性质
化合价
氢化物 单质 氧化物 酸 碱 盐
+5
+4
+3
+2
0
-3
NH3
NH4+
N2
N2O3
N2O4
N2O5
NO
NO2
HNO3
HNO2
NH3 H2O
NO3-
NO2-
硝酸具有很强的氧化性,浓度不同,与金属反应的产物不同
活动二:通过实验探究 学习硝酸的性质
2、硝酸的化学性质
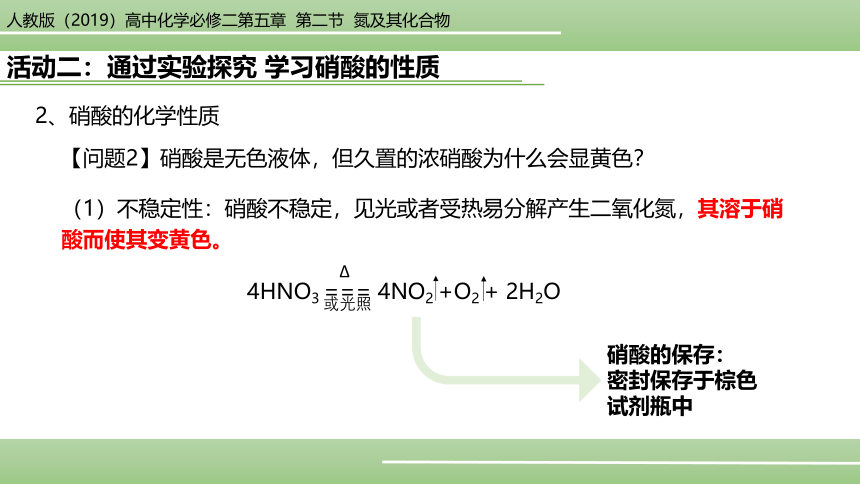
【问题2】硝酸是无色液体,但久置的浓硝酸为什么会显黄色?
(1)不稳定性:硝酸不稳定,见光或者受热易分解产生二氧化氮,其溶于硝酸而使其变黄色。
4HNO3 === 4NO2 +O2 + 2H2O
或光照
硝酸的保存:
密封保存于棕色试剂瓶中
活动二:通过实验探究 学习硝酸的性质
2、硝酸的化学性质
(1) 实验5-8 实验仪器、药品 实验操作 实验现象 实验结论
具支试管、铜丝、烧杯、硝酸、氢氧化钠
铜与稀硝酸反应和浓硝酸均能发生反应,且反应产物不同。
1、常温下,铜丝与稀硝酸反应的试管内无颜色变化。
2、铜丝与浓硝酸反应的试管产生红棕色气体。
在橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺丝状的铜丝。向两支具支试管中分别加入2mL浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触,观察并比较实验现象。
化学方程式 稀硝酸
浓硝酸
Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
【思考】氢氧化钠的作用?
活动二:通过实验探究 学习硝酸的性质
2、硝酸的化学性质
(2)强氧化性
稀硝酸和浓硝酸都有强氧化性
由于HNO3中的N +5价,处在最高价,故硝酸具有较强的得电子能力……
且浓度越大氧化性越强:浓HNO3>稀HNO3
单击图片观看演示视频
活动二:通过实验探究 学习硝酸的性质
2、硝酸的化学性质
(2)强氧化性——与金属单质反应(除Au、Pt)
硝酸浓度 实验现象 实验结论
浓硝酸 反应 、铜丝 ,产生 色气体,溶液呈绿色 铜与浓硝酸反应生成 ,
化学方程式:_________________
________________________
剧烈
变细
红棕
NO2
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
稀硝酸 反应 、铜丝 ,产生 气体,溶液呈蓝色 铜与稀硝酸反应生成 ,化学方程式:________________________
________________________
缓慢
变细
无色
NO
3Cu+8HNO3(稀)===
3Cu(NO3)2+2NO↑+4H2O
浓硝酸的还原产物为 NO2,稀硝酸的还原产物为 NO 。
活动二:通过实验探究 学习硝酸的性质
2、硝酸的化学性质
(3)酸性:
HNO3 H++NO3-
大多数金属能与硝酸反应,但在常温下,铁和铝会被冷的浓硝酸、浓硫酸钝化,生成一层致密的氧化膜,阻止了酸与内层金属的反应,故可以用铁(铝)槽车运输浓硝酸、浓硫酸
(4)钝化:
活动二:通过实验探究 学习硝酸的性质
①除Au、Pt等少数金属外,硝酸几乎氧化所有的金属。
②常温下,Fe、Al等金属在浓HNO3中发生“钝化”。
④王水(浓HNO3和浓HCl按体积比1:3配制)具有更强的氧化性,能溶解Au、Pt。
③一般来说,金属与硝酸反应
硝酸与金属反应规律
浓硝酸生成NO2,稀硝酸生成NO,都无H2放出。
活泼金属与极稀HNO3反应时,还原产物复杂,可为N2O、NH4NO3等。
中医书籍《本草纲目拾遗》记载的“强水”其实就是“王水”。
小结
活动二:通过实验探究 学习硝酸的性质
3、硝酸在工农业上的应用
生产氮肥
制造炸药
生产硝化纤维塑料
硝酸是重要化工原料,主要用于制造硝酸铵、硝酸铵钙、硝酸磷肥、氮磷钾等复合肥料。作为制硝酸盐类氮肥(如硝酸铵、硝酸钾等)、王水、硝化甘油、硝化纤维素、硝基苯、苦味酸和硝酸酯的必需原料,也用来制取含硝基的炸药。
活动三:通过阅读资料 了解酸雨的形成与防治
活动三:通过阅读资料 了解酸雨的形成与防治
活动三:通过阅读资料 了解酸雨的形成与防治
【问题3】根据以往学习的知识及上述资料,同学们知道什么是酸雨吗?它是如何产生的呢?酸雨对人们的生产生活有哪些危害呢?
3、SO2、NOx 的主要来源
汽车的尾气。
煤、石油和某些含硫的金属矿物的燃烧或冶炼。
4、SO2、NOx的危害:
SO2与NOx会引起呼吸道疾病,严重时会使人死亡。溶于水形成酸雨;
SO2:
NOx:
1、酸雨:主要指 pH小于5.6 的雨水,主要含有硫酸和硝酸
2、成因:主要是大气中的 SO2 与 NOx 溶于雨水形成的
活动三:通过阅读资料 了解酸雨的形成与防治
【问题3】根据以往学习的知识及上述资料,同学们知道什么是酸雨吗?它是如何产生的呢?酸雨对人们的生产生活有哪些危害呢?
类型:
硫酸型:
硝酸型:
途径1
途径2
2SO2+O2 2SO3
△
催化剂
SO3+H2O===H2SO4
NO
HNO3
N2
NO2
3NO2+H2O===2HNO3+NO
2NO+O2 ==2NO2
放电
N2+O2=== 2NO
活动三:通过阅读资料 了解酸雨的形成与防治
【问题3】根据以往学习的知识及上述资料,同学们知道什么是酸雨吗?它是如何产生的呢?酸雨对人们的生产生活有哪些危害呢?
酸雨的危害
活动三:通过阅读资料 了解酸雨的形成与防治
活动三:通过阅读资料 了解酸雨的形成与防治
【问题4】通过相关知识的学习,我们应该如何防治酸雨呢?
(1)使用原煤脱硫技术,除去燃煤中大约40%一60%的无机硫。
(2)优先使用低硫燃料,如含硫较低的低硫煤和天然气等。
(3)改进燃煤技术,减少燃煤过程中二氧化硫和氮氧化物的排放量。
(4)对煤燃烧后形成的烟气在排放到大气中之前进行烟气脱硫。
(5)开发新能源,如太阳能,风能,核能,可燃冰等。
课堂小结
展开更多......
收起↑
 资源预览
资源预览







 资源预览
资源预览








