 资源简介
资源简介
宁远一中2025年第一次月考化学试卷
时量:75分钟 满分:100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na- 23 Mg- 24 Al- 27 S- 32 Cl- 35.5 Mn- -55 Fe- 56 I -127
一、选择题(本题包括14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1. 现代社会的发展与进步离不开材料,下列有关说法不正确的是
A. 碳化硅是一种新型陶瓷材料,具有耐高温耐磨的特点
B. 晶体硅是一种半导体材料,常用于制造光导纤维
C. 硬铝是一种铝合金,是制造飞机和飞船的理想材料
D. 石墨烯是一种新型无机非金属材料,具有高电导率的特点
2. 每年10月23日上午6:02到晚上6:02被誉为“摩尔日”(MoleDay),这个时间的一种写法 为6:02 10/23,外观与阿伏加德罗常数近似值6. 02 ×1023相似。用NA代表阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,18 g水所占的体积约为22.4 L
B. 1 mol OH-中含有电子数为10 NA
C. 0.1molFeCl3·6H2O加入沸水中完全反应生成胶体的粒子数为0.1 NA
D. 将22.4 L HCl配成1 L溶液,c(H+ )为1 mol/L
3. 下列化学用语完全正确的一组是
A. 质量数为31的磷原子:
B. 硫离子结构示意图:
C. 次氯酸电子式:
D. KHSO4熔融电离:KHSO4=K++H++SO42-;KHCO3溶解于水的电离:KHCO3=K++H+ +CO32-
4. 在无色透明溶液中,能大量共存的离子组是
A. 、、、 B. 、、、
C. 、、、 D. 、、、
5.已知Co2O3在酸性溶液中易被还原成Co2+,且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI22FeCl3+4FeI3 B.Cl2+FeI2FeCl2+I2
C.Co2O3+6HCl2CoCl2+Cl2↑+3H2O D.2Fe3++2I 2Fe2++I2
6. 工业上用洗净的废铜屑做原料来制备硝酸铜,从节约原理及防治污染环境的角度考虑,宜采取的方法是
A. B.
C. D.
7. 下列离子方程式正确的是
A. 钠与水反应:
B. 0.01 mol/L 溶液与0.02 mol/L 溶液等体积混合:
C. 少量通入溶液中:
D. 向溶液中通入足量:
8.以太阳能为热源的铁氧化合物循环法分解水制H2的过程如图所示。下列叙述错误的是( )
A.过程I的化学方程式为2Fe3O4==太阳能==6FeO+O2↑
B.过程Ⅱ的反应属于氧化还原反应
C.铁氧化合物循环法制H2具有节约能源、产物易分离等优点
D.该总反应中,每消耗1molH2O能产生1molH2,转移1mol电子
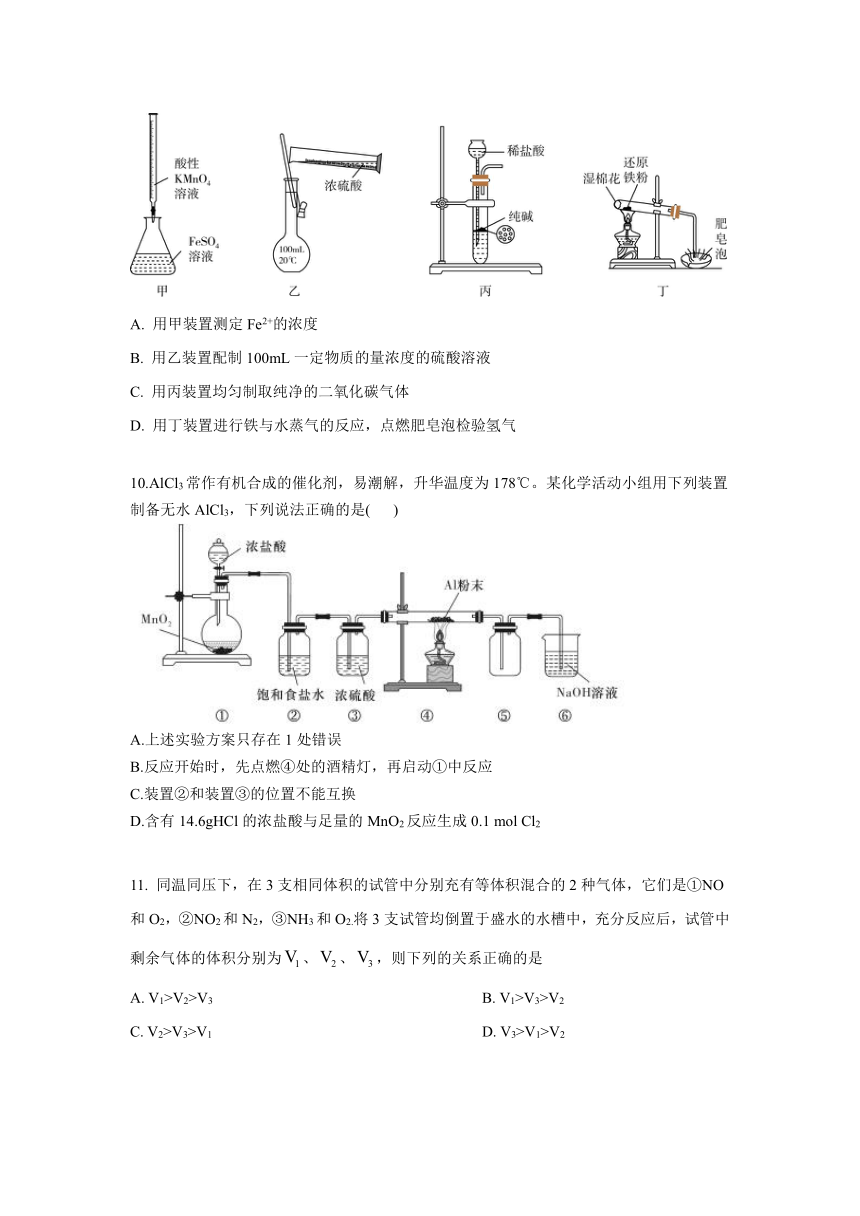
9. 用下列实验装置进行相应实验,装置正确且能达到相应实验目的是
A. 用甲装置测定Fe2+的浓度
B. 用乙装置配制100mL一定物质的量浓度的硫酸溶液
C. 用丙装置均匀制取纯净的二氧化碳气体
D. 用丁装置进行铁与水蒸气的反应,点燃肥皂泡检验氢气
10.AlCl3常作有机合成的催化剂,易潮解,升华温度为178℃。某化学活动小组用下列装置制备无水AlCl3,下列说法正确的是( )
A.上述实验方案只存在1处错误
B.反应开始时,先点燃④处的酒精灯,再启动①中反应
C.装置②和装置③的位置不能互换
D.含有14.6gHCl的浓盐酸与足量的MnO2反应生成0.1 mol Cl2
11. 同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和O2,②NO2和N2,③NH3和O2.将3支试管均倒置于盛水的水槽中,充分反应后,试管中剩余气体的体积分别为、、,则下列的关系正确的是
A. V1>V2>V3 B. V1>V3>V2
C. V2>V3>V1 D. V3>V1>V2
12. 一定量的铁粉和铜粉混合物加入到一定量稀硝酸中,充分反应后剩余固体g,再向溶液中加入一定量的稀硫酸,充分反应后,剩余固体质量为g。则和的关系是
A. B. C. D. 不能确定
13. 某稀溶液中含有3.5molKNO3和2.2molH2SO4,向其中加入1.2molFe,充分反应(已知NO3-被还原为NO)。下列说法正确的是
A. 反应过程中转移电子数3NA
B. 反应后生成NO体积为24.4L
C. 所得溶液中c(Fe2+):c(Fe3+)=1∶3
D. 所得溶液中c(NO3-)=2.4mol/L
14. 碳酸氢铵常用作膨松剂、缓冲剂。一种制备碳酸氢铵的流程如图所示,已知氨气极易溶于水,“合成”过程中发生了化合反应。下列说法错误的是
A. “造气”时,需要控制好煤与空气的用量,减少CO的生成
B. 常温常压下,等体积的N2、H2、NH3、CO2所含分子数均相同
C. 为了获得更多的NH4HCO3,可以先向水中通入足量CO2,再通入足量NH3
D. N2、H2合成NH3时,每转移3mole-,生成17gNH3
三、非选择题(本题包括4小题,共58分)
15. A、B、D、E、X均为中学化学常见物质,相互转化关系如图所示(部分物质略去)。
I.若A为气体单质,气体B能使湿润红色石蕊试纸变蓝,E为红棕色气体。
(1)实验室制取B的化学方程式为_______。
(2)D和CO均是汽车尾气的主要成分,通过汽车尾气催化转化装置生成无污染气体,降低污染物排放,写出该反应的化学方程式:_______。
II.若A是淡黄色固体,B中阴、阳离子均为10电子粒子,常温下X是无色气体。
(3)A与X反应的化学方程式:_______。
(4)将一定量的气体X通入B的溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。吸收X后的B溶液中的溶质为_______,物质的量之比为_______。
III.若A、X为单质,D能使品红溶液褪色。
(5)B与D反应生成A的化学方程式为_______。
(6)铜与E的浓溶液反应的化学方程式为_______。
16. X、Y、Z、M、R、Q是短周期主族元素,部分信息如表所示:
X Y Z M R Q
原子半径/nm 0.186 0.074 0.099 0.143
主要化合价 -4,+4 -2 -1,+7 +3
其他 阳离子核外无电子 无机非金属材料的主角 焰色试验呈黄色
(1)Z的单质与水反应的化学方程式为___________。
(2)Y与R相比,非金属性较强的是___________(用元素符号表示),下列事实能证明这一结论的是___________(填标号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:
c.最高价氧化物对应的水化物的酸性:
(3)根据表中数据推测Y的原子半径的范围:______________________。
(4)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙丙+水,则丙的化学式为___________(写出一种即可)。
17.(14分)废物利用对保护环境、节约资源和带动社会效益起着积极作用。某废旧金属材料主要为铜、铝、铁及其氧化物的混合物,利用该材料得到胆矾的一种流程如下:
已知:调pH可将Fe3+与Cu2+分离,但不易将Fe2+与Cu2+分离。
请回答下列问题:
(1)流程中“粉碎”的目的是________________。
(2)“碱浸”时发生反应的离子方程式为________________。
(3)“酸浸”后“氧化”时发生反应的离子方程式为________________;该过程温度不宜过高,原因为________________。
(4)“滤渣2”的成分为________________(填化学式);“一系列操作”不能采用直接蒸发结晶的原因为________________。
(5)有同学从上述流程中的“氧化”和“调pH”联想到过氧化钠也具有氧化性,且与水反应能生成氢氧化钠。于是向硫酸亚铁溶液中加入一定量的过氧化钠固体,观察到有红褐色固体产生且无气体生成。若过氧化钠与硫酸亚铁反应的物质的量之比为1:2,则该反应的离子方程式为________________。
18. 某化学兴趣小组为探究和的还原性强弱,进行下列实验:
(1)取0.2mol 和0.4mol NaI固体溶于水,配成100mL混合溶液;配制上述混合液需要的玻璃仪器除胶头滴管、玻璃棒、烧杯、量筒之外,还需要___________。配制溶液过程中,所用蒸馏水需要加热到沸腾,然后冷却使用,原因是___________。
(2)取(1)中配制的溶液5mL于一洁净的试管中,滴加少量的1.0mol/L的稀硝酸1mL,振荡之后,溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
甲同学认为是因为稀硝酸氧化了,生成了单质,碘溶于水呈黄色;则甲认为反应的离子方程式为___________。
乙同学认为是因为稀硝酸氧化了,生成了,含的水溶液呈黄色;则乙认为反应的离子方程式为___________。
丙同学认为是因为稀硝酸氧化了,生成了,同时产生的NO在空气中被氧化成,溶于硝酸成黄色。
(3)随后化学兴趣小组进行如下实验进行验证:
实验步骤 实验现象 结论
①取少量黄色溶液于试管中,滴加淀粉溶液 试管中溶液变成蓝色 甲同学观点正确
②取少量黄色溶液于试管中,滴加KSCN溶液 ___________ 乙同学观点不正确
③取1.0mol/L的稀硝酸5mL,加入铜片 产生无色气体,在试管口上方,气体变成红棕色,溶液呈蓝色 丙同学观点不正确
④另取少量KI溶液于试管中,滴加过量的1.0mol/L的稀硝酸,反应后再滴加淀粉溶液 产生无色气体,滴加淀粉溶液后溶液为无色 过量的硝酸能够将氧化成更高价态的
在上述实验②中的现象为___________。由实验①和②对比,得出结论:还原性强弱为大于。实验③表明,稀硝酸和铜片反应生成的NO只在试管口被氧化成,并没有大量溶于水,溶液不会呈黄色。实验④中反应的离子方程式为___________。
根据上述结论,取(1)中配制的溶液10mL于一洁净的大试管中,加入某浓度的稀硝酸适量,充分反应,产生标准状况下的无色气体mol,则该总反应的离子方程式为___________。
化学自测题答案
B 2. B 3. A 4. B 5. A 6. C 7. B 8. D 9. D 10. C 11. C 12. A 13. C 14. C
15.(1)Ca(OH)2+ 2NH4ClCaCl2+ 2NH3↑ + 2H2O
(2)2CO + 2NON2+ 2CO2
(3)2CO2+ 2Na2O2=2Na2CO3+ O2
(4) ①. NaOH、Na2CO3 ②. 1:2
(5)
(6)
16.(1)
(2) ①. ②. bc
(3) ①. 0.099 ②. 0.143
(4)(或)
17.(14分)
(1)增大反应物接触面积,加快反应速率,使废旧金属充分反应
(2)
(3) 温度过高H2O2会分解,降低氧化效率
(4)Fe(OH)3 直接蒸发结晶易使胆矾失去结晶水
(5)
18.(1)①. 100mL容量瓶 ②. 除去溶于水中的氧气,防止氧气将和氧化变质
(2) ①.
②.
(3) ①. 溶液不变红色 ②.
(4)
展开更多......
收起↑
 资源预览
资源预览



 资源预览
资源预览



