 资源简介
资源简介
广东省高州市十三校联考2024-2025学年九年级下学期5月月考化学试题
一、选择题
1.下列过程属于化学变化的是
A.房屋倒塌 B.道路冲毁 C.钢铁生锈 D.铜作导线
2.每年的5月20日是“中国学生营养日”。处于生长发育期的青少年每天要摄入一定量的蛋类、鱼虾类、奶类等食物,这三类食物富含的基本营养素是
A.油脂 B.糖类 C.蛋白质 D.维生素
3.下列物质按照混合物、氧化物、单质顺序排列的是( )
A.空气、二氧化锰、氧气
B.海水、氯酸钾、氢气
C.氧化铁、锰酸钾、水
D.硫酸铜、高锰酸钾、二氧化碳
4.在“实验室制取及检验二氧化碳”的实验中,下列图示或实验操作正确的是
A.制取 B.收集
C.检验 D.的验满
5.将密封良好的饼干从平原带到高原,包装袋会鼓起的原因是
A.袋内气体分子数目增多 B.袋内单个气体分子质量变大
C.袋内气体分子间的间隔变大 D.袋内气体分子的种类变多
6.要使如图装置中的小气球鼓起来,则使用的固体和液体可以是
①石灰石和稀盐酸 ②硝酸铵和水 ③固体氢氧化钠和水 ④氯化钠和水 ⑤二氧化锰和过氧化氢溶液
A.①②③④ B.①③⑤ C.①②④⑤ D.②③④
7.中和反应在工农业生产和日常生活中有广泛的用途,下列应用与中和反应无关的是
A.使用熟石灰改良酸性土壤
B.在蚊虫叮咬处涂肥皂水等碱性物质,可减轻痛痒
C.稀硫酸和氧化铜反应制取硫酸铜
D.硫酸厂的污水可以用消石灰进行处理
8.下列化学用语正确的是
A.2个硝酸根离子: B.两个氮分子:2N2
C.硝酸银:HgNO3 D.一个锡原子:Zn
9.下列实验操作中,“先”与“后”的顺序不正确的是
A.制备气体时,先检查装置的气密性,后装好药品
B.给试管内少量液体加热时,先预热,后集中加热
C.固体和液体混合时,先加固体,再加液体
D.高锰酸钾制取氧气时,实验结束,先熄灭酒精灯再移出导管
10.下图是KNO3和NaCl两种固体物质的溶解度曲线(不考虑水分的蒸发,析出的晶体中不含结晶水)。下列说法正确的是
A.50℃时,将185.5g的KNO3饱和溶液降温到20℃,析出晶体的质量为53.9g
B.NaCl的溶解度小于KNO3的溶解度
C.20℃时,NaCl饱和溶液的溶质质量分数为36.0%
D.若KNO3中混有少量的NaCl,可用蒸发结晶的方法提纯KNO3
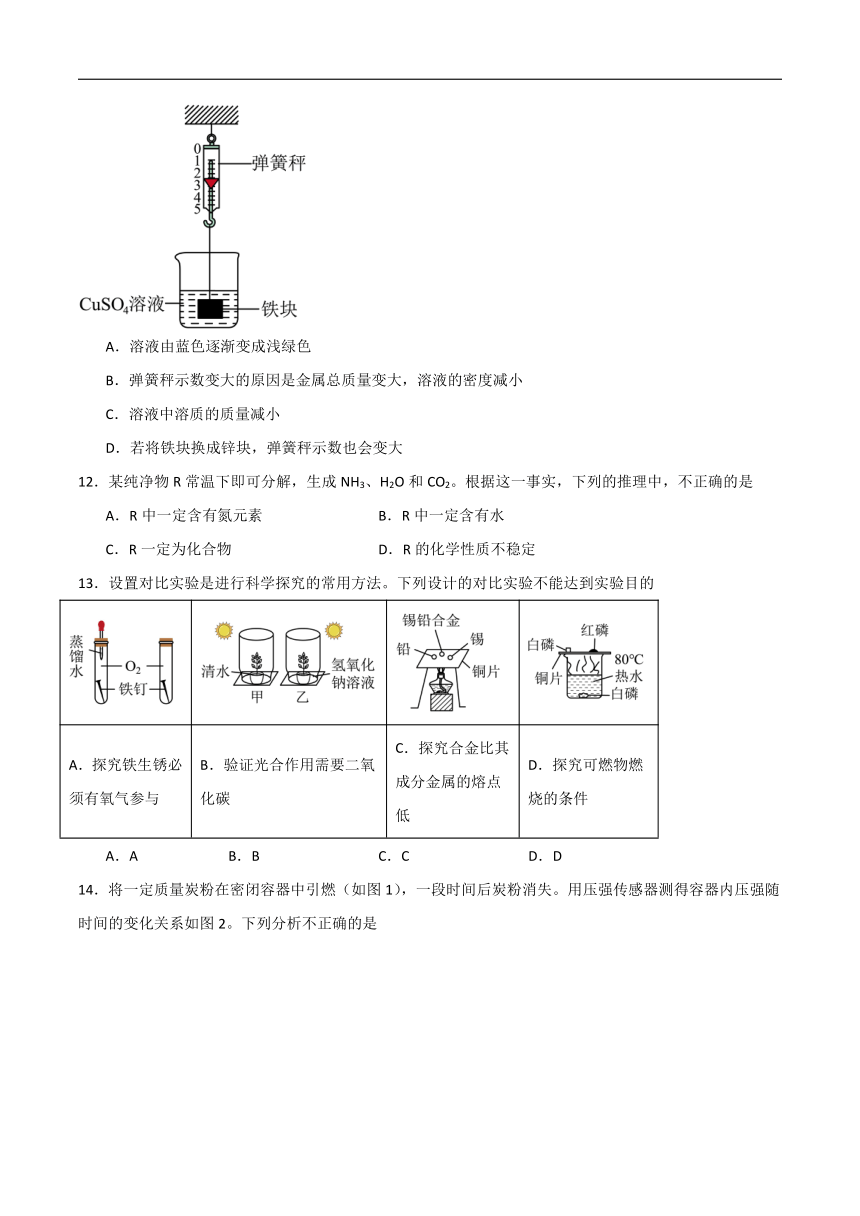
11.通常情况下,相同体积的溶液中溶质质量越大,溶液密度越大。如下图,将悬挂在弹簧秤上的铁块浸没在 CuSO4中,一段时间后,弹簧秤的示数变大,溶液体积变化忽略不计。下列有关表述错误的是
A.溶液由蓝色逐渐变成浅绿色
B.弹簧秤示数变大的原因是金属总质量变大,溶液的密度减小
C.溶液中溶质的质量减小
D.若将铁块换成锌块,弹簧秤示数也会变大
12.某纯净物R常温下即可分解,生成NH3、H2O和CO2。根据这一事实,下列的推理中,不正确的是
A.R中一定含有氮元素 B.R中一定含有水
C.R一定为化合物 D.R的化学性质不稳定
13.设置对比实验是进行科学探究的常用方法。下列设计的对比实验不能达到实验目的
A.探究铁生锈必须有氧气参与 B.验证光合作用需要二氧化碳 C.探究合金比其成分金属的熔点低 D.探究可燃物燃烧的条件
A.A B.B C.C D.D
14.将一定质量炭粉在密闭容器中引燃(如图1),一段时间后炭粉消失。用压强传感器测得容器内压强随时间的变化关系如图2。下列分析不正确的是
A.AB段炭粉开始燃烧
B.反应放热以及生成气体导致BC段压强增大
C.装置内发生反应的化学方程式为:C+O2CO2
D.可向装置内加澄清石灰水检验燃烧产物
15.下列实验方案设计完全合理的是
A.除去NaCl固体中的少量AgCl,可加足量水溶解,过滤
B.除去CuSO4溶液中的少量H2SO4,可加足量CuO,过滤
C.除去碳粉中的二氧化锰,可加足量H2O2溶液,过滤
D.除去碳酸钙中的氧化钙,可将固体进行高温煅烧
二、填空与简答
16.中华文化博大精深,化学知识推动了科技的发展。
(1)石油古称“消水”,《汉书》中记载有“高奴县有消水可燃”。石油属于 (填“可再生”或“不可再生”)能源。
(2)《梦溪笔谈》中有“熬胆矾铁釜久之亦化为铜”的记载,说明铁的活动性比铜 (填“强”或“弱”)。
(3)《天工开物》中记载,硫磺对火药的制作至关重要。请写出硫在空气中燃烧的化学方程式: 。
(4)新材料和新能源的使用是时代进步的重要标志。
①新材料石墨烯具有密度小、硬度大、柔软,有优良的导电性及抗拉伸能力。下列关于它的用途说法错误的是 (填序号)。
A.制折叠手机屏幕 B.制绝缘手套 C.制超导材料
②氢气作为新能源,正在受到越来越多的关注,其优点是 (写一点)。
(5)李商隐“春蚕到死丝方尽”中的“蚕丝”属于 (填“天然”或“合成”)纤维。
17.阅读下面科普短文,回答有关问题:
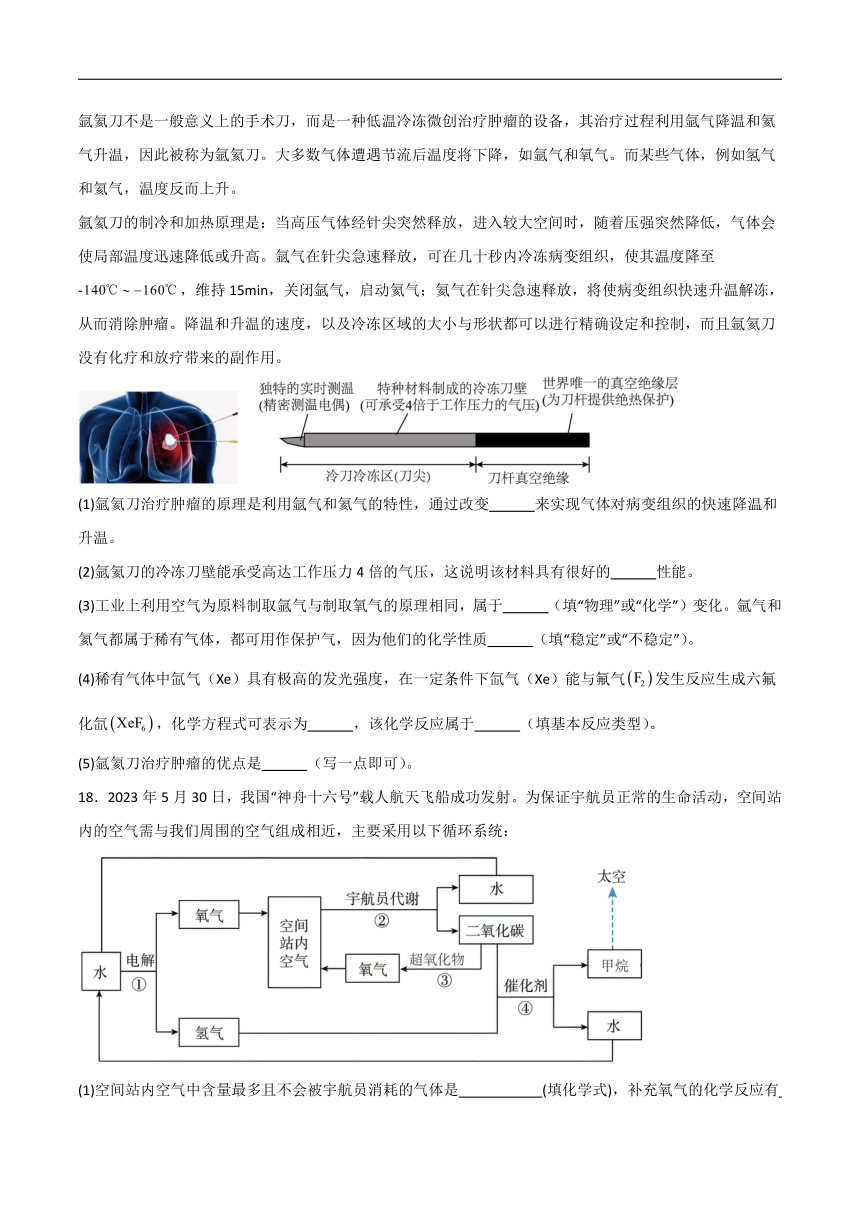
利用氩氦刀治疗肿瘤
氩氦刀不是一般意义上的手术刀,而是一种低温冷冻微创治疗肿瘤的设备,其治疗过程利用氩气降温和氦气升温,因此被称为氩氦刀。大多数气体遭遇节流后温度将下降,如氩气和氧气。而某些气体,例如氢气和氦气,温度反而上升。
氩氦刀的制冷和加热原理是:当高压气体经针尖突然释放,进入较大空间时,随着压强突然降低,气体会使局部温度迅速降低或升高。氩气在针尖急速释放,可在几十秒内冷冻病变组织,使其温度降至-,维持15min,关闭氩气,启动氦气;氦气在针尖急速释放,将使病变组织快速升温解冻,从而消除肿瘤。降温和升温的速度,以及冷冻区域的大小与形状都可以进行精确设定和控制,而且氩氦刀没有化疗和放疗带来的副作用。
(1)氩氦刀治疗肿瘤的原理是利用氩气和氦气的特性,通过改变 来实现气体对病变组织的快速降温和升温。
(2)氩氦刀的冷冻刀壁能承受高达工作压力4倍的气压,这说明该材料具有很好的 性能。
(3)工业上利用空气为原料制取氩气与制取氧气的原理相同,属于 (填“物理”或“化学”)变化。氩气和氦气都属于稀有气体,都可用作保护气,因为他们的化学性质 (填“稳定”或“不稳定”)。
(4)稀有气体中氙气(Xe)具有极高的发光强度,在一定条件下氙气(Xe)能与氟气发生反应生成六氟化氙,化学方程式可表示为 ,该化学反应属于 (填基本反应类型)。
(5)氩氦刀治疗肿瘤的优点是 (写一点即可)。
18.2023年5月30日,我国“神舟十六号”载人航天飞船成功发射。为保证宇航员正常的生命活动,空间站内的空气需与我们周围的空气组成相近,主要采用以下循环系统:
(1)空间站内空气中含量最多且不会被宇航员消耗的气体是 (填化学式),补充氧气的化学反应有 (填序号)。
(2)反应①所发生的反应是通过太阳能电池产生的直流电来电解水,该反应的化学方程式为 ,其反应的基本类型为 。
(3)反应④的化学方程式是 ;此系统中循环利用的物质有 、 、二氧化碳和氢气。
(4)航天工程代表着一个国家综合竞争实力和科技水平,要应用到与资源、能源、材料和环境密切相关的现代技术。例如“天和一号”资源舱舱段采用了高强度的铝锂合金—材料问题,请结合你所认识的航天技术,举出一例说: (如能源、资源、环境等问题)。
三、实验题
19.根据下列实验室制取气体的装置,回答下列有关问题。
(1)仪器a的名称是 。
(2)实验室用大理石和稀盐酸制取二氧化碳。
①发生反应的化学方程式为 。
②选择的发生装置为 。
③一般情况下,不能用排水法收集CO2,小华同学改用温水收集到了CO2,从物质溶解度的角度解释,其原因是 。
(3)如图F,向石蕊溶液中通入CO2气体,观察到溶液变为红色,反应方程式为 。
(4)实验室用装置A制取氧气的化学反应原理是 (用化学方程式表示)。
(5)小兴查阅资料得知:
①氨气极易溶于水,其水溶液称为氨水;
②氨水在浓度大或受热时易分解放出氨气。
实验室常用生石灰和浓氨水快速制取氨气,制得的氨气 (填“能”或“不能”)用装置D收集。
四、科学探究题
20.金属在生产生活中用途广泛。某化学小组进行金属和酸反应的实验探究。
实验探究一:
(1)取形状、大小相同的纯锌片和纯铜片,用砂纸打磨,打磨的目的是 ,然后同时放入稀硫酸中,如图1所示。
(2)图1观察到的现象是:锌片表面产生气泡,铜片表面 。实验时甲同学不小心将两种金属片触碰到了一起(如图2),意外地发现铜片表面产生了气泡。
实验探究二:
【提出问题】图2中产生的气体是什么?铜是否发生了化学反应?
【作出猜想】猜想I:二氧化硫;猜想Ⅱ:氧气,猜想Ⅲ:氢气。
(3)提出以上猜想的依据是 。
【查阅资料】①将锌片、铜片用导线连接后平行插入稀硫酸中,金属失去的电子通过导线发生了转移。
②二氧化硫能使品红溶液褪色。
(4)【进行实验】同学们将纯锌片和纯铜片用导线连接,放入装有稀硫酸的U形管中,铜片表面有气泡产生,在右侧导管口处检验生成的气体(如图3)。
①甲同学将生成的气体通入装有品红溶液的试管中,观察到 ;猜想Ⅰ不成立。
②乙同学将带火星木条放在右侧导管口,木条不复燃,猜想Ⅱ (填“成立”或“不成立”)。
③丙同学将 放在右侧导管口,气体被点燃,猜想Ⅲ成立。写出气体燃烧的化学方程式 。
【教师释疑】图1实验中,锌与稀硫酸反应,锌失去电子,酸溶液中的H+在锌片表面获得电子生成H2。
【学生感悟】(5)图3实验中,酸溶液中的H+从铜片表面获得 (填“锌”或“铜”)失去的电子生成了H2。
【得出结论】图2中两种金属触碰后铜没有发生化学反应。
【延伸应用】(6)轮船是由钢铁制造的,易被海水侵蚀。船壳的吃水线以下会安装一定数量的某种金属块,让金属块被腐蚀来保护船壳。这种金属可以是 (填字母)。
A.锌 B.铜 C.银
五、计算题
21.小明为了测定某硫酸溶液中溶质的质量分数,如图甲,向60g硫酸溶液中缓缓注入质量分数为10%的氢氧化钠溶液,测得溶液的pH与氢氧化钠溶液的质量对应关系如图乙。请回答下列问题:
(1)配制质量分数为10%的氢氧化钠溶液,若量筒量取水时俯视读数,会导致所配氢氧化钠溶液的溶质质量分数 (填“偏大”“偏小”或“不变”)。
(2)图乙中a点溶液含有的溶质是 。
(3)请计算硫酸溶液中溶质的质量分数(写出计算过程,结果保留至0.1%)。
参考答案
1.C
2.C
3.A
4.B
5.C
6.B
7.C
8.B
9.D
10.A
11.D
12.B
13.A
14.A
15.B
16.(1)不可再生
(2)强
(3)S+O2SO2
(4) B 燃烧产物是水,无污染(或热值高等)
(5)天然
17.(1)压强
(2)抗压
(3) 物理 稳定
(4) 化合反应
(5)没有化疗和放疗带来的副作用(合理即可)
18.(1) N2 ①③
(2) 分解反应
(3) 水 氧气
(4)太阳电池帆板提供电能—能源问题
飞船和空间站里需要建立水循环体系—资源问题
航天火箭采用环保型新燃料—环境问题等
19.(1)试管
(2) CaCO3+2HCl=CaCl2+H2O+CO2↑ B 气体的溶解度随温度的升高而减小,温水温度高,二氧化碳的溶解度小,容易收集
(3)CO2+H2O=H2CO3
(4)2KMnO4K2MnO4+MnO2+O2↑
(5)不能
20. 除去金属表面的氧化物 无明显现象 根据质量守恒定律,化学反应前后,元素的种类不变 品红溶液不褪色 不成立 燃着的木条 锌 A
21.(1)偏大
(2)氢氧化钠、硫酸钠
(3)
由图可知,加入氢氧化钠溶液的质量为20g时,pH=7,此时氢氧化钠和稀硫酸恰好完全反应
解:设硫酸溶液中溶质的质量分数为x
x≈4.1%
答:硫酸溶液中溶质的质量分数为4.1%
展开更多......
收起↑
 资源预览
资源预览


 资源预览
资源预览




