 资源简介
资源简介
新疆实验中学2024-2025学年第二学期高二年级期中考试
化学试卷(问卷)
(卷面分值:100分 考试时间:90分钟)
注意事项:
1.本试卷为问答分离式试卷,共10页,其中问卷8页,答卷2页。答题前请考生务必将自己的班级、姓名、准考证号的信息填写在答题卡上。
2.作答非选择题时必须用黑色字迹0.5毫米签字笔书写在答题卡的指定位置上,作答选择题必须用2B铅笔在答题卡上将对应题目的选项涂黑。如需改动,请用橡皮擦干净后,再选涂其它答案,请保持答题卡卡面清洁、不折叠、不破损、不能使用涂改液、修正带。
3.考试结束后,请将答题卡交回。
4.可能用到的相对原子质量:H-1 B-11 C-12 N-14 O-16 Mg-24 Cu-64 S-32
一、选择题:本大题共20题,每小题2.5分,共计50分。在每小题列出的四个选项中只有一项是最符合题目要求的。
1.20世纪20年代中期建立的量子力学理论不仅能够较圆满的解释原子光谱的实验事实,而且为解释和预测物质结构和性质提供了全新的理论支持,已经成为现代化学理论的基础。依据该理论,下列各项叙述中正确的是
A.所有原子任一能层的s电子云轮廓图都是球形,电子绕核运动,其轨道为球面
B.钠的焰色试验呈现黄色,是电子由激发态转化成基态时吸收能量产生的
C.4s轨道电子能量较高,总是在比3s轨道电子离核更远的地方运动
D.s轨道电子能量可能高于p轨道电子能量
2.下列说法错误的是
A.ns能级电子的能量可能低于(n-1)p能级电子的能量
B.6C的电子排布图为:,违反了洪特规则
C.21Sc电子排布式:1s22s22p63s23p63d3违反了能量最低原理
D.22Ti电子排布式:1s22s22p63s23p10违反了泡利原理
3.下列说法错误的是
A.基态钾离子(K+),电子占据的最高能级共有3个原子轨道,其形状是哑铃形
B.在现代化学中,常利用光谱分析法来鉴定元素
C.同一原子处于激发态时的能量一定高于其处于基态时的能量
D. 违背了泡利不相容原理
4.下列原子结构相关内容表述正确的是
A.3px、3py、3pz轨道能量不相同
B.原子核外电子只能在电子云轮廓内运动
C.电子排布图违背了泡利原理
D.电子由3s能级跃迁至3p能级时,可以用光谱仪摄取其吸收光谱
5.下列有关原子核外电子排布的说法,正确的是
A.外围电子排布不同的两种氮原子:①②,能量E①>E②
B.基态硒原子的价层电子排布式为3d104s24p4
C.同一原子中,2p、3p、4p能级的轨道数目依次增多
D.基态铍原子的最外层电子云轮廓图为
6.江西为环西太平洋成矿带的组成部分,矿产资源丰富。其中居第一位的有铜、钨、钽、铯、铊、钪、金、银、铀、钍、伴生硫、溶剂白云岩等,居第二位的有稀土、硒、碲、铷、锂等,居第三位的有磷钇矿、铋、铍、岩盐、蛇纹岩等,居第四位的有钼、铌、萤石等,居第五位的有锡、锆、玻璃用白云岩等。下列说法正确的有
A.锡在元素周期表的p区 B.铜的价层电子中未成对电子数为2
C.钪的价电子排布式是3d14s1 D.硒的第一电离能大于砷
7.下列说法正确的是
A.有机酸的酸性比较CH3CHClCOOH>CH3CH2COOH>CH3CH(CH3)COOH
B.“X—H…Y”三原子不在一条直线上时,不可能形成氢键
C.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高
D.N的电负性比P的大,可推断NCl3分子中N-Cl键的极性比PCl3分子中的P-Cl键大
8.下列对分子结构及其性质的解释中,错误的是
A.P4在CS2中的溶解度很大,因其是非极性分子
B.沸点:<,因为前者形成了分子间氢键
C.羟基乙酸[CH2(OH)COOH]不具有手性,因其分子中不存在手性碳原子
D.酸性:CF3-COOH>CH3-COOH,因F的电负性大,使-COOH中O-H极性增强
9.下列与键参数有关的说法中错误的是
A.键角:CO2>H2O>CH4
B.键长:Si-H>P-H>S-H>Cl-H
C.键能:E(H-F)>E(H-Cl)>E(H-Br)>E(H-I)
D.结构相似的分子,共价键的键能越大,分子通常越稳定
10.用价层电子对互斥模型可以判断许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断正确的是
A.BeF2的空间结构为V形
B.SO3键角为120°,NH3的键角大于120°
C.CH2O的VSEPR模型和分子空间结构一致
D.AsCl3、的空间结构都是三角锥形
11.X、Y、Z、W、R、Q是原子序数依次增大的短周期主族元素,其中基态X原子核外电子只有一种自旋取向,YX3的VSEPR模型为平面三角形,X与Q形成的化合物能刻蚀玻璃。下列说法正确的是
A.Y、Z、W三种元素中,W的最高价含氧酸酸性最强
B.X分别与Z、W形成的化合物中,前者的沸点一定低于后者
C.与R同周期且第一电离能大于R的元素有2种
D.只由X、W、R三种元素形成的化合物一定为共价化合物
12.下列说法正确的是
A.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
B.σ键是电子云“肩并肩”重叠形成的,而π键则是“头碰头”重叠形成的
C.CF4、CCl4、CBr4中C-X(X=F、Cl、Br)键长、键角均相等
D. 中σ键和π键的数目之比为4:1
13.价层电子对互斥理论可以预测某些微粒的空间结构。下列说法错误的是
A.NF3和的空间结构均为三角锥形
B.PH3和PCl3均为非极性分子
C.AsH3和H2Se的VSEPR模型均为四面体形
D.SO2和H2O均为V形结构
14.磷酸氯喹在细胞水平上能有效抑制新型冠状病毒的感染,其结构简式如图所示。下列说法正确的是
A.电负性:N>O>C B.该有机物中碳原子采取sp、sp2杂化
C.基态氢原子电子云轮廓图为哑铃形 D.的空间结构与VSEPR模型相同
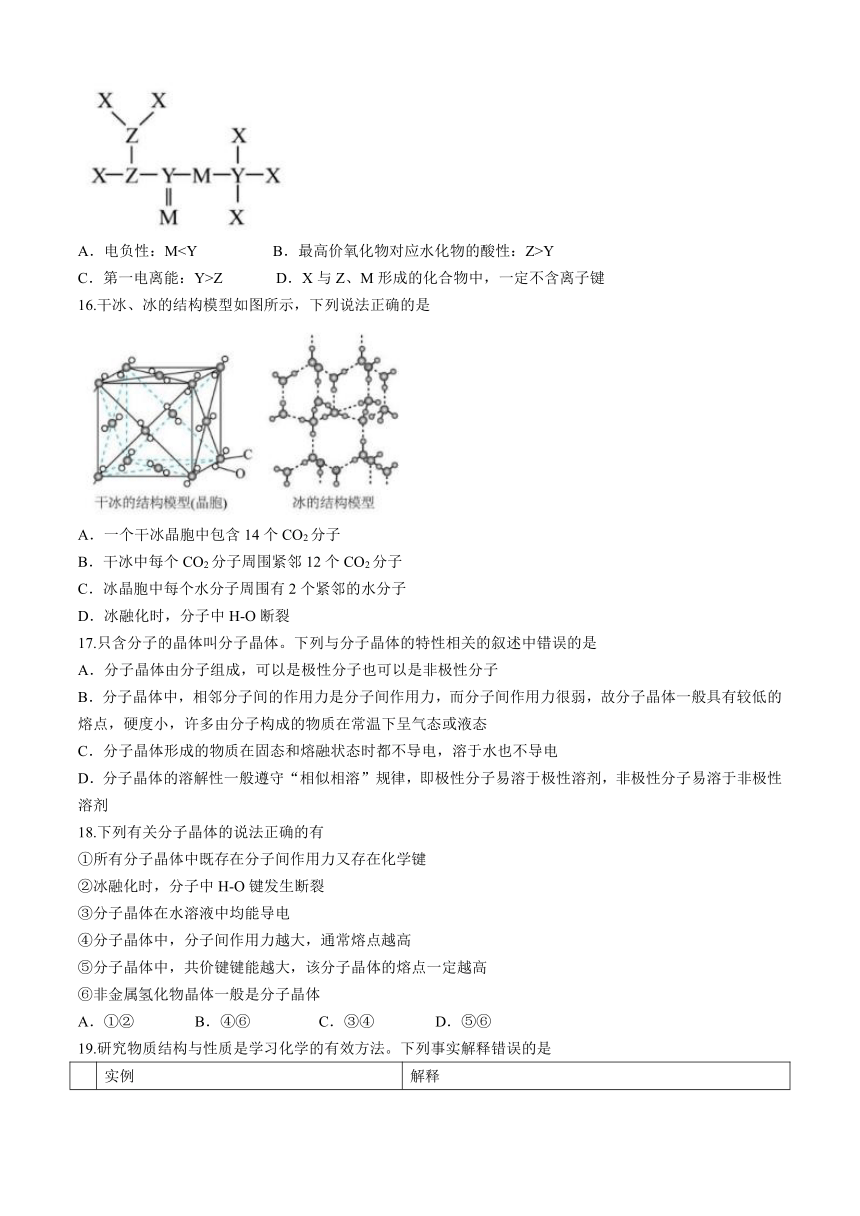
15.短周期主族元素X、Y、Z、M的原子序数依次增大,Z的基态原子的2p轨道半充满,M的最高正价与最低负价的绝对值之差为4,由这4种元素组成的一种分子的结构如图所示。下列说法正确的是
A.电负性:MY
C.第一电离能:Y>Z D.X与Z、M形成的化合物中,一定不含离子键
16.干冰、冰的结构模型如图所示,下列说法正确的是
A.一个干冰晶胞中包含14个CO2分子
B.干冰中每个CO2分子周围紧邻12个CO2分子
C.冰晶胞中每个水分子周围有2个紧邻的水分子
D.冰融化时,分子中H-O断裂
17.只含分子的晶体叫分子晶体。下列与分子晶体的特性相关的叙述中错误的是
A.分子晶体由分子组成,可以是极性分子也可以是非极性分子
B.分子晶体中,相邻分子间的作用力是分子间作用力,而分子间作用力很弱,故分子晶体一般具有较低的熔点,硬度小,许多由分子构成的物质在常温下呈气态或液态
C.分子晶体形成的物质在固态和熔融状态时都不导电,溶于水也不导电
D.分子晶体的溶解性一般遵守“相似相溶”规律,即极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂
18.下列有关分子晶体的说法正确的有
①所有分子晶体中既存在分子间作用力又存在化学键
②冰融化时,分子中H-O键发生断裂
③分子晶体在水溶液中均能导电
④分子晶体中,分子间作用力越大,通常熔点越高
⑤分子晶体中,共价键键能越大,该分子晶体的熔点一定越高
⑥非金属氢化物晶体一般是分子晶体
A.①② B.④⑥ C.③④ D.⑤⑥
19.研究物质结构与性质是学习化学的有效方法。下列事实解释错误的是
实例 解释
A 乙酸的酸性大于丙酸 乙基比甲基的推电子效应大,乙酸羧基中的羟基极性大
B 萘和碘在水中的溶解度不大,但易溶于四氯化碳 萘、碘、四氯化碳为非极性分子,水是极性分子
C 干冰在工业中广泛用作制冷剂 干冰为分子晶体,常压极易升华,升华过程吸热
D 甲醇的沸点比甲醛的沸点高 均为分子晶体,甲醇的相对分子质量更大,分子间范德华力大
A.A B.B C.C D.D
20.反萤石在熔融条件下具有良好的导电性,其晶胞如图所示。已知晶胞边长为anm,阿伏加德罗常数的值为NA.下列叙述错误的是
A.该晶体的化学式为Mg2C
B.该晶体中碳的配位数为4
c.晶胞中碳原子与镁原子的最短距离为anm
D.该晶胞密度为g/cm3
二、简答题:本大题共4题,共计50分。
21.现有A、B、C、D、E、X、Y、Z、M九种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738kJ/mol,I2=1451kJ/mol,I3=7733kJ/mol,I4=10540kJ/mol
X:同周期元素的简单离子中半径最小
Y:主族序数与周期数的差为4
Z:前四周期主族元素中电负性最小
M:位于元素周期表中的第八列
(I)C2A4的电子式为__________。
(2)B元素的原子核外共有__________种不同运动状态的电子。
(3)某同学推断E元素基态原子的核外电子轨道表示式为。该同学所画的轨道表示式违背了__________,解释E元素原子的第一电高能大于X元素原子的第一电离能的原因:__________。
(4)已知T元素和Cl元素的电负性分别为1.5和3.0,则它们形成的化合物是__________(填“离子化合物”或“共价化合物”)。
(5)与Z元素同周期的基态原子中,未成对电子数与H原子相同的元素有__________种,M位于元素周期表中__________区(按电子排布分区)。
22.Ⅰ.(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.
常温常压下SnCl4为无色液体,SnCl4空间构型为__________。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为__________(填化学式,下同),键角由大到小的顺序为__________。
(3)常温下,在水中的溶解度乙醇大于氯乙烷,原因是__________。
(4)比较给出H+能力的相对强弱:H2O__________C2H5OH(填“>”“<”或“=”)。
Ⅱ.研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。
回答下列问题:
(1)CO2和CH3OH分子中C原子的杂化形式分别为___________和__________。
(2)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为__________,原因是__________。
23.按要求回答下列问题:
(1)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示。
①在该晶胞中,含Cu+的个数为__________,O2-的配位数是__________。
②若该晶胞的边长为apm,则Cu2O的密度为__________g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
(2)金属镍(Ni)与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。
储氢原理:镧镍合金吸附H2,H2解离为原子,H原子储存在其中形成化合物。
若储氢后,氢原子占据晶胞中上下底面的棱心和面心,则形成的储氢化合物的化学式为___________。
(3)S与A、B两种金属形成的晶胞如图所示,B的配位数为________,该化合物的化学式为_________。
24.硼酸(H3BO3)是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂,回答下列问题:
(1)下列有关硼酸晶体的说法正确的是________。
A.H3BO3分子的稳定性与氢键有关
B.含1molH3BO3的晶体中有3mol氢键
C.分子中B、O最外层均为8e-稳定结构
D.硼原子杂化轨道的类型为sp2,同层分子间的主要作用力是范德华力
(2)H3BO3分子中的O-B-O的键角_________(填“大于”“等于”或“小于”)中的H-B-H的键角,判断依据是___________。
(3)一种硼酸盐的阴离子为,n=_________;
结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出的结构图(注明所带电荷数):________。
(4)硼酸晶体是片层结构,其中一层的结构如图所示。
硼酸在冷水中溶解度很小,但在热水中较大,原因是:________。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构如下图所示。该晶胞边长为apm,晶胞中原子a与原子b之间的距离为________pm,该晶体的密度为________g/cm3.
新疆实验中学2024-2025学年第二学期高二年级期中考试
化学试卷(答案)
(卷面分值:100分考试时间:90分钟)
一、选择题:本大题共20题,每小题2.5分,共计50分。在每小题列出的四个选项中只有一项是最符合题目要求的。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
答案 D A D D A A A B A C A A B D B B C B D B
二、非选择题:本大题共4小题,共计50分
21.
(1)
(2)6
泡利原理
从全满半满角度答
(4)共价化合物(1分)
(5)5d(1分)
I.(1)正四面体形(1分)
(2)、、、、
(3)乙醇与水之间形成氢键而氯乙烷没有
(4)>(1分)
II.(1)sp(1分)(1分)
与均为极性分子,中氢键比甲醇多;
与均为非极性分子,的相对分子质量较大、范德华力较大
23.(1)44
(2)
(3)4
24.(1)B
(2)大于H3BO3分子中的B采取sp2杂化,而BH中的B采取sp3杂化,sp2杂化形成的键角大于sp3杂化形成的键角(2分)
(3)3(2分)
(4)晶体中硼酸分子间以氢键缔合在一起,难以溶解;
加热时,晶体中部分氢键被破坏,硼酸分子与水分子形成氢键,溶解度增大(2分)
(5)a (2分)
展开更多......
收起↑
 资源预览
资源预览



 资源预览
资源预览



